Kristalna struktura
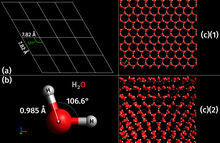


Kristalna struktura je karakteristika čvrstih tela, koja je određena pravilnom strukturom čestica od kojih je telo građeno.[3] Ovakva čvrsta tela čiji su atomi ili atomske grupe pravilno prostorno raspoređeni nazivaju se kristalima. Pravilnosti prostorne raspoređenosti atoma se izražavaju i kod eksternih osobina kristala, npr. kod kristala natrijum hlorida (kuhinjske soli). Vidljivo je da svaki kristal natrijum hlorida predstavlja gotovo savršenu kocku. U ovom slučaju se ta pravilnost proteže na veliki deo, odnosno na celi komad ispitivanog materijala, pa se ta osobina naziva makrokristalnošću, a materijal - monokristal. U protivnom slučaju tj. kada se pravilnost proteže na malu oblast materijala, tada kristalnost postoji u malim razmerama pa se osobina naziva polikristalnošću, a materijal - polikristal. Kristalna struktura daje čvrstim materijalima veću mehaničku čvrstinu, dok sa druge strane nepravilna (amorfna) struktura utiče na žilavost. Proces promene agregatnog stanja supstance, iz tečnog u čvrsto, pri čemu dolazi do formiranja kristala koji imaju pravilnu strukturu se naziva kristalizacija.
Prema vrsti čestica i njihovih veza razlikuju se atomske, jonske i molekularne kristalne rešetke. Tako na primer rešetka je natrijum hlorida (kuhinjska so) jonska (građena od natrijumovih i hlorovih jona), rešetka dijamanta je atomska s kovalentnom vezom između ugljenikovih atoma, rešetka benzena je molekularna i tako dalje. Osnovne gradivne čestice kristala nalaze se na tačno određenim i stalnim položajima u jediničnoj ćeliji, osnovnoj, najmanjoj zapremini prostorne rešetke, koji sadrži najmanji mogući broj strukturnih jedinica. Periodičkim ponavljanjem jedinične ćelije duž 3 nekoplanarna racionalna smera izgrađena je cela kristalna rešetka, to jest celi kristal. Svaka jedinična ćelija ima oblik paralelopipeda i određena je s pomoću smera i dužine tri brida, te sa tri ugla među bridovima, a oblik ćelije mora imati najveću (maksimalnu) simetriju nekoga kristalnog sistema.
Osnovno je načelo (princip) prostorne rešetke: svaki čvor rešetke ima jednak broj susednih čvorova na jednakoj udaljenosti i jednako raspoređenih, to jest čvorovi se ni po čemu međusobno ne razlikuju. S obzirom na moguće jedinične ćelije, postoji 14 međusobno različitih prostornih rešetki, koje nose naziv Braveove rešetke (prema A. Braveu). Njih sedam (triklinska, monoklinska, rompska, trigonska, tetragonska, heksagonska i kubna) nazivaju se primitivnim, jer imaju čvorove (mesta u kristalu s identičnom okolinom u istom smeru) samo u uglovima jedinične ćelije. Ostalih sedam su centrirane rešetke s dodatnim čvorovima u sredini ćelije, na suprotnim parovima ploča ili u sredini tih ploča. U Braveovim rešetkama postoji samo translacijska simetrija kristalne rešetke. Potpuna simetrija neke kristalne rešetke, to jest kristalne strukture, opisana je jednom od 230 prostornih, Fedorovovih grupe simetrije (prema J. S. Fedorovu). Bravesove rešetke i Fedorove grupe predstavljaju unutrašnju simetriju (mikrosimetriju) kristala.[4]
Podela[uredi | uredi izvor]
Prema vrsti veze i rasporedu gradivnih elemenata razlikuju se:
- metalna kristalna rešetka
- atomska kristalna rešetka
- molekularna kristalna rešetka
- jonska kristalna rešetka
| tip kristala | Primeri | Energija veze kJ/mol | Tip hemijske veze | Strukturne jedinice | Karakteristike kristala |
| jonski | NaCl
LiF |
753,624
1004,832 |
jonska (heteropolarna) | pozitivni i negativni joni | Tvrdi i krti, visoka tačka topljenja, jaka infracrvena apsorpcija, mala električna provodnost na niskim temperaturama, dobra jonska provodnost na visokim temperaturama. Topljivi u rastvaračima tipa vode. Rastvori i rastopi su su jonski provodnici. |
| kovalentni | dijamant
SiC |
~711,756
1184,8644 |
kovalentna (homopolarna) | atomi | Velika tvrdoća, visoka tačka topljenja, niska električna provodnost, praktično nerastvorni u svim rastvaračima. |
| metalni | Na
Fe |
108,8568
3935592 |
metalna | joni metala | Tvrdi i kovni, visoka tačka topljenja, metalni sjaj, visoka električna i toplotna provodnost, rastvorni samo u tekućim metalima. |
| molekularni | Ar
CH4 |
7,53624
10,04832 |
van der Valsove sile | atomi ili molekuli | Mekani, niska tačka topljenja, relativno velika kompresibilnost, niska električna provodljivost, rastvorni u organskim rastvaračima. |
| s vodičnim vezama | H2O (led)
HF |
50,2416
29,3076 |
vodonična | atomi ili molekuli | U odnosu na molekularne kristale veća energija veze, viša tačka topljenja, pomak karakterističnih traka u infracrvenim spektrima prema nižim frekvencijama, veće dielektrične konstante; tendencija ka polimerizaciji. |
Prostorna rešetka kristala[uredi | uredi izvor]
Prostorna rešetka kristala ili translaciona grupa je skup tačaka definisanih sa vektorom translacije rešetke. Pošto su atomi, odnosno atomske rešetke grupa atoma pravilno raspoređene, moguće je u prostoru definisati tri vektora elementarne translacije:
, , . Ovi vektori predstavljaju periode kristalne rešetke u tri različita pravca, nazivaju se ortovima rešetke ili ortovima vektora translacije rešetke koji je dat sledećom formulom:
Elementarna ćelija[uredi | uredi izvor]
Prostorna rešetka kristala se sada uz pomoć vektora translacije dobija uzimajući sve vrednosti celih brojeva za , i , dok se paralelopiped koji se dobija uzimajući vrednosti , i = 1, naziva elementarnom ćelijom. Treba napomenuti da čvorovi kristala u kojima se nalaze atomi se ne poklapaju u opštem slučaju sa vrhovima ortova , i . Ovakva notacija definisana vektorom translacije ukazuje na pravilnost, ali nam ne govori u gde se nalaze atomi. Samo u posebnim slučajevima mogu se čvorovima rešetke pripisati i atomi ili atomske grupe[5].
Kristalni sistemi[uredi | uredi izvor]
Kristalni sistem predstavlja kategoriju karakterisanu na osnovu vrste prostorne rešetke kristala. Elementarna ćelija je definisana kao najmanja prostorna jedinica kristala, njenim pravilnim pomeranjem u prostoru za udaljenosti koje su jednaka njenim dimenzijama dobijamo prostornu rešetku. Kristalni sistem za slučaj kada su ortovi i kada između sebe grade prave uglove od 90° se naziva kubični, i on ima najviše elemenata simetrije. U opštem slučaju ortovi nisu jednaki i mogu činiti međusobne proizvoljne uglove α, β i γ. U zavisnosti od ovih vrednosti izvršena je podela na 7 kristalnih sistema za kojih ima 14 kombinacija elementarnih ćelija koje se drugačije nazivaju i Braveove ćelije.
Klasifikacija[uredi | uredi izvor]
| Naziv sistema | a | b | c | α | β | γ | tip rešetke | |||
| Triklinski (T) | a | ≥a | ≤a | ≠90° | ≠90° | ≠90° | 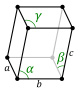
| |||
| Monoklinski (M) | a | b | ≤a | ≠90° | 90° | 90° | prosta | baznocentrična | ||

|

| |||||||||
| Ortorombni (OR) | a | <a | >a | 90° | 90° | 90° | prosta | baznocentrična | prostornocentrična | površinskicentrična |

|

|
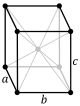
|

| |||||||
| Tetragonalni (TE) | a | a | ≠a | 90° | 90° | 90° | prosta | prostornocentrična | ||

|

| |||||||||
| Rombni (R) | a | a | a | α = β = γ ≠ 90° | 
| |||||
| Heksagonalni (H) | a | a | c | 90° | 90° | 120° | 
| |||
| Kubični (K) | a | a | a | 90° | 90° | 90° | Prosta | prostornocentrična | površinskicentrična | |
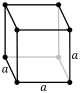
|

|

| ||||||||
Neke strukture[uredi | uredi izvor]
Kubični kristalni sistem[uredi | uredi izvor]
Kuhinjska so[uredi | uredi izvor]

Struktura kuhinjske soli ili natrijum hlorida je takva struktura kod koje odvojeno atomi natrijuma i hlora čine površinski centričnu kubičnu strukturu. U ovoj rešetki svaki jon je okružen sa šest jona drugog elementa; ti joni se nalaze u temenima kocke. Ova ista struktura se nalazi kod mnogih drugih minerala u skoro svim alkalnim halogenidima kao i mnogim dvovalentnim metalnim oksidima, sulfidima, selenidima i teluridima. Uopšteno, u prirodi postoji velika verovatnoća da se formira ovakva struktura. Kristalografska grupa ove strukture se zove "Fm3m" u Herman-Muginovoj notaciji ili "225" u Međunarodnoj tabeli za Kristalografiju. Koordinacija broj svakog atoma u ovoj strukturi je 6: svaki katjon koordinira sa 6 anjona u temenima oktaedra, i slično, svaki anjon je koordiniran sa 6 katjona.
Dijamant[uredi | uredi izvor]

Kristalna struktura dijamanta je nešto složenija struktura koja potpada pod Kubični kristalni sistem. Kad se kaže složenija, misli se na to da ne potpada pod jednostavne kombinacije: prosti, baznocentrični, prostornocentrični niti površinskicentrični, već se predstavlja kao modifikacija jedne od ovih, tj. površinskicentrične kubične rešetke. Struktura dijamanta je važna jer se po njoj, osim samog dijamanta, kristališu poluprovodnici germanijum i silicijum, kao i siva modifikacija kalaja koja je stabilna na temperaturi nižoj od 13 °C. Osnovnu ulogu u ovoj strukturi igraju tetraedrične valentne veze kojima je svaki atom ugljenika vezan sa četiri najbliža suseda raspoređena u tetraedar. Čvrstina i sposobnost dijamanta da prelama svetlost su posledica njegove strukture.
Sfalerit[uredi | uredi izvor]

Kristalna struktura sfalerita (engl. Zincblende structure) zajedno sa strukturom rešetke dijamanta čine dve najvažnije strukture rešetki poluprovodnčkih materijala. Dijamantska struktura kod silicijuma i germanijuma (Si, Ge), a struktura kod galijum arsenida (GaAs) se kristalizuje u strukturu sfalerita. Obe imaju pod dva atoma u osnovi, dok atomi zauzimaju tetraedarsku strukturu, tj. svaki atom je okružen sa četiri najbliža suseda koji leže u temenima tetraedra. Struktura sfalerita se kao i struktura dijamanta može smatrati modifikacijom površinsko centrične kubične strukture. Razlika između njih je to što su u dijamantskoj rešetki svi atomi su istog elementa, recimo silicijuma, dok kod strukture sfalerita na pr. kod galijum arsenida (GaAs) u centru tetraedra se nalazi jedan element koji je okružen sa četiri atoma drugog elementa. Galijum arsenida pripada jedinjenjima elemenata III i V grupe u periodnom sistemu elemenata i većina ovih jedinjenja se kristalizuje u struktura sfalerita. Međutim velik broj poluprovodničkih materijala uključujući i neka jedinjenja iz III-V grupe se kristališu u strukturu natrijum hlorida.
Heksagonalni kristalni sistem[uredi | uredi izvor]
Grafit[uredi | uredi izvor]
Grafit je druga alotropska modifikacija ugljenika koja ima specifičnu kristalnu strukturu. Ugljenikovi atomi obrazuju šestočlane prstenove koji su raspoređeni u paralelnim ravnima (slojevima). Veza između C atoma u slojevima je jaka kovalentna veza, sa rastojanjem između susednih ugljenikovih atoma od 0,145 nm i energijom veze od 4,3 elektron volti. Između slojeva, međutim, deluju slabe Van der Valsove sile, tako da je rastojanje između njih 0,341 nm, a energija veze samo 0,07 elektron volti. Ovaj tip rešetke predstavlja slojevitu rešetku koja grafitu daje specifične osobine. Grafit je veoma mek i služi za podmazivanje, za razliku od dijamanta koji ima atomsku kristalnu rešetku[6].
Vurcit[uredi | uredi izvor]

Vurcit je sulfidni mineral hemijskog sastava (Zn,Fe)S; cinka ili gvožđe sa anjonom sulfida. Sfalerit je istog hemijskog sastava, dok se Vurcit dosta ređe javlja u prirodnom obliku. Vurcit je heksagonalne (šestougaone) strukture u kojoj atomi prave veze sa tetraedarski raspoređenim podjednako udaljenim susednim atomima, slično strukturi sfalerita. Neka poluprovodnička jedinjenja, kao što su cinksulfid ZnS i kadmijumsulfid CdS se mogu kristalizovati u obe strukture; strukturu sfalerita i vurcita. Kod strukture vurcita duž C - ose, tj. optičke ose za razliku od strukture dijamanta javlja se dvojno prelamanje, dihroizam. Drugim rečima, za CdS je anizotropan materijal, dok je recimo silicijum izotropan.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Petrenko, V. F.; Whitworth, R. W. (1999). Physics of Ice. Oxford University Press. ISBN 9780198518945.
- ^ Bernal, J. D.; Fowler, R. H. (1933). „A Theory of Water and Ionic Solution, with Particular Reference to Hydrogen and Hydroxyl Ions”. The Journal of Chemical Physics. 1 (8): 515. Bibcode:1933JChPh...1..515B. doi:10.1063/1.1749327.
- ^ Hook, J.R.; Hall, H.E. (2010). Solid State Physics. Manchester Physics Series (2nd izd.). John Wiley & Sons. ISBN 9780471928041.
- ^ Kristalna rešetka, [1] "Hrvatska enciklopedija", Leksikografski zavod Miroslav Krleža, www.enciklopedija.hr, 2019.
- ^ Dr Dimitrije Tjapkin:Fizička elektronika i elektronska fizika čvrstog tela, Naučna knjiga, Beograd, 1988.
- ^ „Materijali sa Rudarsko-geološkog fakulteta”. Arhivirano iz originala 10. 09. 2015. g. Pristupljeno 9. 4. 2013.
Spoljašnje veze[uredi | uredi izvor]
- The internal structure of crystals... Crystallography for beginners
- Basic types of crystal structures
- Appendix A from the manual for Atoms, software for XAFS
- Intro to Minerals: Crystal Class and System
- Introduction to Crystallography and Mineral Crystal Systems
- Crystal planes and Miller indices
- Interactive 3D Crystal models
- Specific Crystal 3D models










