Spermatogeneza
| Spermatogeneza | |
|---|---|
 Seminiferni tubul sa sazrevanjem spermatozoida. | |
 Spermatozoid zrelog muškarca. | |
| Detalji | |
| Deo | Reproduktivni sistem |
| Funkcija | Proces stvaranja spermatozoida, zrelih muških polnih ćelija |
| Identifikatori | |
| MeSH | D013091 |
| Anatomska terminologija | |
Spermatogeneza je proces kojim se haploidni spermatozoidi razvijaju iz zametnih ćelija u semenskim tubulima testisa. Ovaj proces počinje mitotičkom podelom matičnih ćelija koje se nalaze blizu bazalne membrane tubula.[1] Ove ćelije se nazivaju spermatogonijske matične ćelije. Mitotska podela ovih stvara dve vrste ćelija. Ćelije tipa A obnavljaju matične ćelije, a ćelije tipa B se diferenciraju u primarne spermatocite. Primarni spermatocit se mejotski deli (Mejoza I) na dva sekundarna spermatocita; svaki sekundarni spermatocit se deli na dve jednake haploidne spermatide Mejozom II. Spermatidi se transformišu u spermatozoide (spermu) procesom spermiogeneze.[2] Oni se razvijaju u zrele spermatozoide, poznate i kao spermatozoidi. Dakle, primarni spermatocit daje dve ćelije, sekundarne spermatocite, a dva sekundarna spermatocita svojom podelom proizvode četiri spermatozoida i četiri haploidne ćelije.[3]
Spermatozoidi su zreli muški gameti u mnogim organizmima koji se seksualno razmnožavaju. Dakle, spermatogeneza je muška verzija gametogeneze, čiji je ženski ekvivalent oogeneza. Kod sisara se javlja u semenskim tubulima muških testisa na postepen način. Spermatogeneza u velikoj meri zavisi od optimalnih uslova za pravilno odvijanje procesa i neophodna je za seksualnu reprodukciju.[4] Metilacija DNK i modifikacija histona su uključeni u regulaciju ovog procesa. Počinje tokom puberteta i obično se nastavlja neprekidno do smrti, iako se može uočiti blagi pad u količini proizvedene sperme sa porastom starosti.
Spermatogeneza počinje u donjem delu semene cevi i postepeno ćelije ulaze dublje u cevčice i kreću se duž nje sve dok zreli spermatozoidi ne dođu do lumena, gde se odlažu zreli spermatozoidi. Podela se dešava asinhrono; ako se cev preseče poprečno može se uočiti različita stanja sazrevanja. Grupa ćelija sa različitim stanjima sazrevanja koje se stvaraju u isto vreme naziva se spermatogeni talas.[5]
Svrha[uredi | uredi izvor]
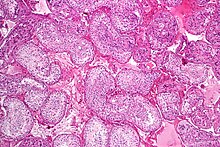
Spermatogeneza proizvodi zrele muške gamete, koje se obično nazivaju spermatozoidi, koje su u stanju da oplode drugi ženski gamet, oocitu, tokom začeća da bi proizvele jednoćelijsku jedinku poznatu kao zigot. Ovo je kamen temeljac seksualne reprodukcije i uključuje dva gameta koje obezbeđuju polovinu normalnog skupa hromozoma (haploidnih) da bi se dobila hromozomski normalan (diploidni) zigot.
Da bi se sačuvao broj hromozoma u potomstvu – koji se razlikuje između vrsta – jedna od svake gamete mora imati polovinu uobičajenog broja hromozoma prisutnih u drugim telesnim ćelijama. U suprotnom, potomci će imati dvostruko veći broj hromozoma od normalnog, što može dovesti do ozbiljnih abnormalnosti. Kod ljudi, hromozomske abnormalnosti koje proističu iz pogrešne spermatogeneze rezultiraju urođenim defektima i abnormalnim urođenim defektima (Daunov sindrom, Klinefelterov sindrom) i u većini slučajeva spontani pobačaj fetusa u razvoju.
Lokacija kod ljudi[uredi | uredi izvor]

Spermatogeneza se odvija u nekoliko struktura muškog reproduktivnog sistema. Početni stadijumi se javljaju unutar testisa i napreduju do epididimisa gde sazrevaju gameti i čuvaju se do ejakulacije. Seminiferni tubuli testisa su polazna tačka za proces, gde se spermatogonijalne matične ćelije koje se nalaze pored unutrašnjeg zida tubula dele u centripetalnom smeru – počevši od zidova i nastavljajući u najdublji deo, ili lumen – da bi proizvele nezrelu spermu.[2] Sazrevanje se javlja u epididimisu. Lokacija [testisi/mošnice] je posebno važna jer proces spermatogeneze zahteva nižu temperaturu da bi se proizvela održiva sperma, tačnije 1°-8° celzijusa niža od normalne telesne temperature od 37°.[6] Klinički, male fluktuacije u temperaturi, kao što su atletske potporne trake, ne uzrokuju oštećenje održivosti ili broja spermatozoida.[7]
Trajnost[uredi | uredi izvor]
Za ljude, ceo proces spermatogeneze se različito procenjuje da traje 74 dana[8][9] (prema biopsijama obeleženim tricijumom) i približno 120 dana[10] (prema merenjima DNK sata). Uključujući transport po duktalnom sistemu, potrebno je 3 meseca. Testisi proizvode 200 do 300 miliona spermatozoida dnevno.[11] Međutim, samo oko polovina ili 100 miliona od njih postaje održiva sperma.[12]
Faze[uredi | uredi izvor]
Ceo proces spermatogeneze može se podeliti na nekoliko različitih faza, od kojih svaka odgovara određenoj vrsti ćelije kod ljudi. U sledećoj tabeli, ploidnost, broj kopija i broj hromozoma/hromatida su za jednu ćeliju, generalno pre sinteze i deobe DNK (u G1 ako je primenjivo). Primarni spermatocit se zaustavlja nakon sinteze DNK i pre deobe.
| Tip ćelije | Ploidija/ broj hromozoma ćelije (ljudska) | Kopije DNK/hromatide (ljudske) | Proces u koji ćelija ulazi |
| spermatogonijum (types Ad, Ap and B) | diploidni (2N) / 46 | 2C / 46 | Spermatocitogeneza (mitoza) |
| Primarna spermatocita | diploidni (2N) / 46 | 4C / 2x46 | Spermatidogeneza (mejoza I) |
| Dve sekundarne spermatocite | haploidni (N) / 23 | 2C / 2x23 | Spermatidogeneza (mejoza II) |
| Četiri spermatide | haploidni (N) / 23 | C / 23 | Spermiogeneza |
| Četiri funkcionalna spermatozoida | haploidni (N) / 23 | C / 23 | Spermijacija |
Spermatocitogeneza[uredi | uredi izvor]

Spermatocitogeneza je muški oblik gametocitogeneze i rezultira formiranjem spermatocita koji poseduju polovinu normalnog komplementa genetskog materijala. U spermatocitogenezi, diploidni spermatogonijum, koji se nalazi u bazalnom odeljku seminifernih tubula, deli se mitotički, proizvodeći dve diploidne srednje ćelije koje se nazivaju primarni spermatociti. Svaki primarni spermatocit se zatim kreće u adluminalni odeljak seminifernih tubula i duplira svoju DNK, a zatim prolazi kroz mejozu I da bi proizveo dva haploidna sekundarna spermatocita, koji će se kasnije još jednom podeliti na haploidne spermatide. Ova podela implicira izvore genetske varijacije, kao što je nasumično uključivanje roditeljskih hromozoma i hromozomsko ukrštanje koje povećava genetsku varijabilnost gamete. Mašina za odgovor na oštećenje DNK (DDR) igra važnu ulogu u spermatogenezi.[13] Protein FMRP se vezuje za mejotske hromozome i reguliše dinamiku DDR mašinerije tokom spermatogeneze. Čini se da je FMRP neophodan za popravku oštećenja DNK.

Svaka deoba ćelije od spermatogonijuma do spermatida je nepotpuna; ćelije ostaju povezane jedna sa drugom mostovima citoplazme kako bi se omogućio sinhroni razvoj. Ne dele se sve spermatogonije da bi proizvele spermatocite; inače bi nestalo zaliha spermatogonije. Umesto toga, spermatogonijalne matične ćelije se mitotički dele da bi proizvele svoje kopije, obezbeđujući konstantno snabdevanje spermatogonije za podsticanje spermatogeneze.[14]
Spermatidogeneza[uredi | uredi izvor]
Spermatidogeneza je stvaranje spermatida iz sekundarnih spermatocita. Ranije proizvedeni sekundarni spermatociti brzo ulaze u mejozu II i dele se da bi proizveli haploidne spermatide. Kratkoća ove faze znači da se sekundarni spermatociti retko vide u histološkim studijama.
Spermiogeneza[uredi | uredi izvor]
Tokom spermiogeneze, spermatidi počinju da formiraju rep tako što rastu mikrotubule na jednom od centriola, koji se pretvara u bazalno telo. Ove mikrotubule formiraju aksonemu. Kasnije se centriol modifikuje u procesu redukcije centrozoma.[15] Prednji deo repa (koji se naziva srednji deo) se deblja jer su mitohondrije raspoređene oko aksonema da bi se obezbedilo snabdevanje energijom. DNK spermatida takođe prolazi kroz pakovanje, postajući visoko kondenzovana. DNK je prvo upakovana specifičnim nuklearnim bazičnim proteinima, koji se kasnije zamenjuju protaminima tokom elongacije spermatida. Dobijeni čvrsto upakovani hromatin je transkripciono neaktivan. Goldžijev aparat okružuje sada kondenzovano jezgro i postaje akrozom.
Sazrevanje se zatim odvija pod uticajem testosterona koji uklanja preostalu nepotrebnu citoplazmu i organele. Višak citoplazme, poznat kao rezidualna tela, fagocitozuju okolne Sertolijeve ćelije u testisima. Dobijeni spermatozoidi su sada zreli, ali nemaju pokretljivost. Zreli spermatozoidi se oslobađaju iz zaštitnih Sertolijevih ćelija u lumen seminifernog tubula u procesu koji se naziva spermacija.
Nepokretni spermatozoidi se transportuju do epididimisa u testisnoj tečnosti koju luče Sertolijeve ćelije uz pomoć peristaltičke kontrakcije. Dok su u epididimisu, spermatozoidi dobijaju pokretljivost i postaju sposobni za oplodnju. Međutim, transport zrelih spermatozoida kroz ostatak muškog reproduktivnog sistema se postiže kontrakcijom mišića, a ne nedavno stečenom pokretljivošću spermatozoida.
Uloga Sertolijevih ćelija[uredi | uredi izvor]
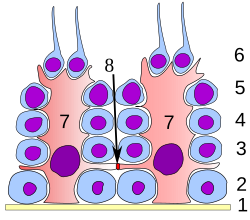
U svim fazama diferencijacije, spermatogene ćelije su u bliskom kontaktu sa Sertolijevim ćelijama za koje se smatra da pružaju strukturnu i metaboličku podršku ćelijama sperme u razvoju. Jedna Sertolijeva ćelija se proteže od bazalne membrane do lumena seminifernog tubula, iako je citoplazmatske procese teško razlikovati na svetlosnom mikroskopskom nivou.
Sertolijeve ćelije obavljaju brojne funkcije tokom spermatogeneze, podržavaju gamete u razvoju na sledeće načine:
- Održavati okruženje neophodno za razvoj i sazrevanje, preko krvno-testisne barijere
- Izlučuju supstance koje iniciraju mejozu
- Luči potpornu tečnost testisa
- luče androgen-vezujući protein (ABP), koji koncentriše testosteron u neposrednoj blizini igre u razvoju
- Testosteron je potreban u veoma velikim količinama za održavanje reproduktivnog trakta, a ABP omogućava mnogo veći nivo plodnosti
- luče hormone koji utiču na kontrolu spermatogeneze hipofize, posebno polipeptidni hormon, inhibin
- Fagocitoza rezidualna citoplazma preostala od spermiogeneze
- Lučenje antimilerovog hormona izaziva propadanje Milerovog kanala[16]
- Zaštitite spermatide od imunog sistema muškarca, preko krvno-testisne barijere
- Doprineti niši spermatogonijskih matičnih ćelija
Molekuli intercelularne adhezije ICAM-1 i rastvorljivi ICAM-1 imaju antagonističke efekte na uske spojeve koji formiraju barijeru krvnog testisa.[17] ICAM-2 molekuli regulišu adheziju spermatida na apikalnoj strani barijere (prema lumenu).[17]
Faktori uticaja[uredi | uredi izvor]
Proces spermatogeneze je veoma osetljiv na fluktuacije u okolini, posebno na hormone i temperaturu. Testosteron je neophodan u velikim lokalnim koncentracijama da bi se održao proces, što se postiže vezivanjem testosterona pomoću proteina koji vezuje androgen prisutan u seminifernim tubulima. Testosteron proizvode intersticijalne ćelije, poznate i kao Lejdigove ćelije, koje se nalaze u blizini seminifernih tubula.
Semenosni epitel je osetljiv na povišenu temperaturu kod ljudi i nekih drugih vrsta i na njega će negativno uticati temperature koje su visoke od normalne telesne temperature. Pored toga, kod većine sisara spermatogonije ne sazrevaju na telesnoj temperaturi, jer je β-polimerazi i spermatogenoj rekombinazi potrebna specifična optimalna temperatura.[18] Shodno tome, testisi se nalaze izvan tela u kožnoj vrećici koja se zove skrotum. Optimalna temperatura se održava na 2 °C (muškarac) (8°C miš) ispod telesne temperature.[19] Ovo se postiže regulacijom protoka krvi i pozicioniranjem prema i dalje od toplote tela pomoću kremasteričnih mišića i glatkih mišića dartos u skrotumu.
Jedan važan mehanizam je termička razmena između testisa arterijske i venske krvi. Specijalizovani anatomski aranžmani sastoje se od dve zone namotavanja duž unutrašnje spermatične arterije. Ovaj anatomski raspored produžava vreme kontakta i termičku razmenu između arterijskih i venskih krvotoka testisa i može, delimično, da objasni temperaturni gradijent između aortne i arterijske krvi testisa prijavljenih kod pasa i ovnova. Štaviše, smanjenje pulsnog pritiska, koje se javlja u proksimalnoj trećini namotane dužine unutrašnje spermatične arterije.[pojasniti][20] [21] Štaviše, smanjuje se aktivnost spermatogene rekombinaze, što bi trebalo da bude važan faktor degeneracije testisa.[pojasniti][22]
Nedostaci u ishrani (kao što su vitamini B, E i A), anabolički steroidi, metali (kadmijum i olovo), izlaganje rendgenskim zracima, dioksin, alkohol i zarazne bolesti takođe će negativno uticati na brzinu spermatogeneze.[23] Pored toga, muška zametna linija je podložna oštećenju DNK uzrokovanom oksidativnim stresom, a ovo oštećenje verovatno ima značajan uticaj na oplodnju i trudnoću.[24] Prema studiji Omida Mehrpura i saradnika, izloženost pesticidima takođe utiče na spermatogenezu.[25]
Hormonalna kontrola[uredi | uredi izvor]
Hormonska kontrola spermatogeneze varira među vrstama. Kod ljudi mehanizam nije u potpunosti shvaćen; međutim, poznato je da se inicijacija spermatogeneze javlja u pubertetu zbog interakcije hipotalamusa, hipofize i Lajdigovih ćelija. Ako se hipofiza ukloni, spermatogeneza se i dalje može pokrenuti folikul stimulišućim hormonom (FSH) i testosteronom.[26] Za razliku od FSH, čini se da luteinizirajući hormon (LH) ima malu ulogu u spermatogenezi osim indukovanja proizvodnje testosterona gonadama.[26][27]
FSH stimuliše i proizvodnju androgen-vezujućeg proteina (ABP) od strane Sertolijevih ćelija i formiranje barijere krvi testisa. ABP je neophodan za koncentraciju testosterona na dovoljno visokim nivoima da započne i održi spermatogenezu. Intratestikularni nivoi testosterona su 20-100 ili 50-200 puta veći od koncentracije u krvi, iako postoje varijacije u rasponu od 5 do 10 puta među zdravim muškarcima.[28][29] Proizvodnja testosterona ne ostaje konstantna tokom dana, već prati cirkadijalni ritam. Maksimalni vrh testosterona se javlja u 8 sati ujutro, što objašnjava zašto muškarci često pate od jutarnjih erekcija. Kod mlađih muškaraca, vrhovi testosterona su viši. FSH može pokrenuti sekvestriranje testosterona u testisima, ali kada se jednom razvije, potreban je samo testosteron za održavanje spermatogeneze.[26] Međutim, povećanje nivoa FSH će povećati proizvodnju spermatozoida sprečavanjem apoptoze spermatogonije tipa A. Hormon inhibin deluje na smanjenje nivoa FSH. Studije na modelima glodara sugerišu da gonadotropini (i LH i FSH) podržavaju proces spermatogeneze suzbijanjem proapoptotičkih signala i stoga promovišu opstanak spermatogenih ćelija.[30]
Same Sertolijeve ćelije posreduju u delovima spermatogeneze kroz proizvodnju hormona. Oni su sposobni da proizvode hormone estradiol i inhibin. Lejdigove ćelije su takođe sposobne da proizvode estradiol pored svog glavnog proizvoda testosterona. Utvrđeno je da je estrogen neophodan za spermatogenezu kod životinja.[31][32] Međutim, pronađeno je da muškarac sa sindromom neosetljivosti na estrogen (defektan ERα) proizvodi spermu sa normalnim brojem spermatozoida, iako abnormalno niskom održivošću sperme; da li je bio sterilan ili ne, nejasno je. Previsoki nivoi estrogena mogu biti štetni za spermatogenezu zbog supresije sekrecije gonadotropina i produžetka intratestikularne proizvodnje testosterona.[33] Čini se da je veza između spermatogeneze i nivoa prolaktina umerena, pri čemu optimalni nivoi prolaktina odražavaju efikasnu proizvodnju sperme.[27][34]
Poremećaji[uredi | uredi izvor]
Poremećaji spermatogeneze mogu uzrokovati oligospermiju, što je sperma sa niskom koncentracijom sperme[35] i čest je nalaz kod muške neplodnosti.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ de Kretser, D. M.; Loveland, K. L.; Meinhardt, A.; Simorangkir, D.; Wreford, N. (1998-04-01). „Spermatogenesis”. Human Reproduction (na jeziku: engleski). 13 (suppl_1): 1—8. ISSN 0268-1161. PMID 9663765. doi:10.1093/humrep/13.suppl_1.1
 .
.
- ^ a b Sharma S, Hanukoglu A, Hanukoglu I (2018). „Localization of epithelial sodium channel (ENaC) and CFTR in the germinal epithelium of the testis, Sertoli cells, and spermatozoa.”. Journal of Molecular Histology. 49 (2): 195—208. PMID 29453757. S2CID 3761720. doi:10.1007/s10735-018-9759-2.
- ^ „The Spermatozoön, in Gray's Anatomy”. Pristupljeno 2010-10-07.
- ^ Song, Ning; Liu, Jie; An, Shucai; Nishino, Tomoya; Hishikawa, Yoshitaka; Koji, Takehiko (2011). „Immunohistochemical Analysis of Histone H3 Modifications in Germ Cells during Mouse Spermatogenesis”. Acta Histochemica et Cytochemica. 44 (4): 183—90. PMC 3168764
 . PMID 21927517. doi:10.1267/ahc.11027.
. PMID 21927517. doi:10.1267/ahc.11027.
- ^ Schulze, W. (24. 4. 2009). „Evidence of a Wave of Spermatogenesis in Human Testis”. Andrologia. 14 (2): 200—207. PMID 7103139. S2CID 42304875. doi:10.1111/j.1439-0272.1982.tb03124.x
 .
.
- ^ "scrotum". Encyclopædia Britannica. Encyclopædia Britannica Online. Encyclopædia Britannica Inc., 2015. Web. 14 Jan. 2015 <http://www.britannica.com/EBchecked/topic/530078/scrotum>.
- ^ Wang C, McDonald V, Leung A, Superlano L, Berman N, Hull L, Swerdloff RS (1997). „Effect of increased scrotal temperature on sperm production in normal men”. Fertil. Steril. 68 (2): 334—9. PMID 9240266. doi:10.1016/s0015-0282(97)81525-7
 .
.
- ^ Heller CG, Clermont Y (1964). „Kinetics of the germinal epithelium in man”. Recent Prog Horm Res. 20: 545—571. PMID 14285045.
- ^ Amann RP (2008). „The cycle of the seminiferous epithelium in humans: a need to revisit?”. J Androl. 29 (5): 469—487. PMID 18497337. doi:10.2164/jandrol.107.004655.
- ^ Forster P, Hohoff C, Dunkelmann B, Schürenkamp M, Pfeiffer H, Neuhuber F, Brinkmann B (2015). „Elevated germline mutation rate in teenage fathers”. Proc R Soc B. 282 (1803): 20142898. PMC 4345458
 . PMID 25694621. doi:10.1098/rspb.2014.2898.
. PMID 25694621. doi:10.1098/rspb.2014.2898.
- ^ Padubidri, VG; Daftary, SN, ur. (2011). Shaw's Textbook of Gynaecology (15th izd.). Elsevier (A Divisionof Reed Elsevier India Pvt. Limited). str. 201. ISBN 978-81-312-2548-6.
- ^ Johnson L, Petty CS, Neaves WB (1983). „Further quantification of human spermatogenesis: germ cell loss during postprophase of meiosis and its relationship to daily sperm production”. Biol. Reprod. 29 (1): 207—15. PMID 6615966. doi:10.1095/biolreprod29.1.207
 .
.
- ^ Alpatov R, Lesch BJ, Nakamoto-Kinoshita M, Blanco A, Chen S, Stützer A, Armache KJ, Simon MD, Xu C, Ali M, Murn J, Prisic S, Kutateladze TG, Vakoc CR, Min J, Kingston RE, Fischle W, Warren ST, Page DC, Shi Y (maj 2014). „A chromatin-dependent role of the fragile X mental retardation protein FMRP in the DNA damage response”. Cell. 157 (4): 869—81. PMC 4038154
 . PMID 24813610. doi:10.1016/j.cell.2014.03.040.
. PMID 24813610. doi:10.1016/j.cell.2014.03.040.
- ^ Fishelson, Lev; Gon, Ofer; Holdengreber, Vered; Delarea, Yakob (2007). „Comparative spermatogenesis, spermatocytogenesis, and spermato-zeugmata formation in males of viviparous species of clinid fishes (Teleostei: Clinidae, Blennioidei)”. The Anatomical Record. 290 (3): 311—23. PMID 17525946. S2CID 25069965. doi:10.1002/ar.20412
 .
.
- ^ Atypical centrioles during sexual reproduction Tomer Avidor-Reiss*, Atul Khire, Emily L. Fishman and Kyoung H. Jo Curr Biol. 2015 Nov 16;25(22):2956-63. doi: 10.1016/j.cub.2015.09.045. Epub 2015 Oct 17. http://journal.frontiersin.org/article/10.3389/fcell.2015.00021/full
- ^ Hadley, Mac E.; Levine, Jon E. (2007). Endocrinology (6th izd.). Upper Saddle River, NJ: Prentice Hall. str. 369. ISBN 978-0-13-187606-4.
- ^ a b Xiao, X.; Mruk, D. D.; Cheng, C. Y. (2013). „Intercellular adhesion molecules (ICAMs) and spermatogenesis”. Human Reproduction Update. 19 (2): 167—86. PMC 3576004
 . PMID 23287428. doi:10.1093/humupd/dms049.
. PMID 23287428. doi:10.1093/humupd/dms049.
- ^ „Spermatogenesis”. Spermatogenesis. Pristupljeno 12. 1. 2022.
- ^ Harrison, RG; Weiner, JS (1949). „Vascular patterns of the mammalian testis and their functional significance”. The Journal of Experimental Biology. 26 (3): 304—16, 2 pl. PMID 15407652. doi:10.1242/jeb.26.3.304.
- ^ Wallach, Edward E.; Kandeel, Fouad R.; Swerdloff, Ronald S. (1. 1. 1988). „Role of temperature in regulation of spermatogenesis and the use of heating as a method for contraception”. Fertility and Sterility. 49 (1): 1—23. PMID 3275550. doi:10.1016/S0015-0282(16)59640-X
 .
.
- ^ Cameron, R. D. A.; Blackshaw, A. W. (1. 5. 1980). „The effect of elevated ambient temperature on spermatogenesis in the boar”. Reproduction. 59 (1): 173—179. PMID 7401033. doi:10.1530/jrf.0.0590173
 .
.
- ^ Hotta, Yasuo; Fujisawa, Masato; Tabata, Satoshi; Stern, Herbert; Yoshida, Shonen (1. 9. 1988). „The effect of temperature on recombination activity in testes of rodents”. Experimental Cell Research. 178 (1): 163—168. PMID 2900772. doi:10.1016/0014-4827(88)90387-4.
- ^ Jenardhanan, Pranitha; Panneerselvam, Manivel; Mathur, Premendu P. (2016-11-01). „Effect of environmental contaminants on spermatogenesis”. Seminars in Cell & Developmental Biology. Molecular Mechanisms in Spermatogenesis (na jeziku: engleski). 59: 126—140. ISSN 1084-9521. PMID 27060550. doi:10.1016/j.semcdb.2016.03.024.
- ^ Lewis, S. E. M.; Aitken, R. J. (24. 5. 2005). „DNA damage to spermatozoa has impacts on fertilization and pregnancy”. Cell and Tissue Research. 322 (1): 33—41. PMID 15912407. S2CID 27592293. doi:10.1007/s00441-005-1097-5.
- ^ Mehrpour, Omid; Karrari, Parissa; Zamani, Nasim; Tsatsakis, Aristides M.; Abdollahi, Mohammad (oktobar 2014). „Occupational exposure to pesticides and consequences on male semen and fertility: A review”. Toxicology Letters. 230 (2): 146—156. PMID 24487096. S2CID 39443009. doi:10.1016/j.toxlet.2014.01.029.
- ^ a b v William J. Kraemer; A. D. Rogol (15. 4. 2008). The Encyclopaedia of Sports Medicine: An IOC Medical Commission Publication, The Endocrine System in Sports and Exercise. John Wiley & Sons. str. 286—. ISBN 978-0-470-75780-2.
- ^ a b Fody EP, Walker EM (1985). „Effects of drugs on the male and female reproductive systems”. Ann. Clin. Lab. Sci. 15 (6): 451—8. PMID 4062226.
- ^ Wolf-Bernhard Schill; Frank H. Comhaire; Timothy B. Hargreave (26. 8. 2006). Andrology for the Clinician. Springer Science & Business Media. str. 76—. ISBN 978-3-540-33713-3.
- ^ Eberhard Nieschlag; Hermann M. Behre; Susan Nieschlag (26. 7. 2012). Testosterone: Action, Deficiency, Substitution. Cambridge University Press. str. 130—. ISBN 978-1-107-01290-5..
- ^ Pareek, Tej K.; Joshi, Ayesha R.; Sanyal, Amartya; Dighe, Rajan R. (2007). „Insights into male germ cell apoptosis due to depletion of gonadotropins caused by GnRH antagonists”. Apoptosis. 12 (6): 1085—100. PMID 17268770. S2CID 25378624. doi:10.1007/s10495-006-0039-3.
- ^ O'Donnell L, Robertson KM, Jones ME, Simpson ER (2001). „Estrogen and spermatogenesis”. Endocr. Rev. 22 (3): 289—318. PMID 11399746. doi:10.1210/edrv.22.3.0431
 .
.
- ^ Carreau S, Bouraima-Lelong H, Delalande C (2012). „Role of estrogens in spermatogenesis”. Front Biosci. 4 (1): 1—11. PMID 22201851. doi:10.2741/e356
 .
.
- ^ Edmund S. Sabanegh Jr. (20. 10. 2010). Male Infertility: Problems and Solutions. Springer Science & Business Media. str. 83—. ISBN 978-1-60761-193-6.
- ^ Spaggiari, Giorgia; Costantino, Francesco; Granata, Antonio R. M.; Tagliavini, Simonetta; Canu, Giulia; Varani, Manuela; De Santis, Maria Cristina; Roli, Laura; Trenti, Tommaso; Simoni, Manuela; Santi, Daniele (2023-08-01). „Prolactin and spermatogenesis: new lights on the interplay between prolactin and sperm parameters”. Endocrine (na jeziku: engleski). 81 (2): 330—339. ISSN 1559-0100. PMID 37140814. S2CID 258485662. doi:10.1007/s12020-023-03375-x.
- ^ thefreedictionary.com > oligospermia Citing: Dorland's Medical Dictionary for Health Consumers, 2007 by Saunders; The American Heritage Medical Dictionary 2007, 2004 by Houghton Mifflin Company; Mosby's Medical Dictionary, 8th edition 2009; McGraw-Hill Concise Dictionary of Modern Medicine, 2002 by The McGraw-Hill Companies
Dalje čitanje[uredi | uredi izvor]
- Okano, Tsukasa; Ishiniwa, Hiroko; Onuma, Manabu; Shindo, Junji; Yokohata, Yasushi; Tamaoki, Masanori (23. 3. 2016). „Effects of environmental radiation on testes and spermatogenesis in wild large Japanese field mice ( Apodemus speciosus ) from Fukushima”. Scientific Reports. 6 (1): 23601. Bibcode:2016NatSR...623601O. PMC 4804236
 . PMID 27005329. doi:10.1038/srep23601.
. PMID 27005329. doi:10.1038/srep23601. - Johnson, L.; Blanchard, T.L.; Varner, D.D.; Scrutchfield, W.L. (novembar 1997). „Factors affecting spermatogenesis in the stallion”. Theriogenology. 48 (7): 1199—1216. PMID 16728209. doi:10.1016/s0093-691x(97)00353-1.
- Bardin, C.W. (1991). „Pituitary-testicular axis”. Ur.: Yen, S.S.C.; Jaffee, R.B. Reproductive Endocrinology (3rd izd.). Philadelphia: WB Saunders. ISBN 0721632068.
- Chambers, Christopher V.; Shafer, Mary-Ann; Adger, Hoover; Ohm-Smith, Marilyn; Millstein, Susan G.; Irwin, Charles E.; Schachter, Julius; Sweet, Richard (februar 1987). „Microflora of the urethra in adolescent boys: Relationships to sexual activity and nongonococcal urethritis”. The Journal of Pediatrics. 110 (2): 314—321. PMID 3100755. doi:10.1016/s0022-3476(87)80180-4.
- Czyba, J.C.; Girod, C. (1980). „Development of normal testis”. Ur.: Hafez, E.S.E. Descended and Cryptorchid Testis. The Hague: Martinus Nijhoff. ISBN 9024723337.
- Whitmore, Willet F.; Karsh, Lawrence; Gittes, Ruben F. (oktobar 1985). „The Role of Germinal Epithelium and Spermatogenesis in the Privileged Survival of Intratesticular Grafts”. Journal of Urology. 134 (4): 782—786. PMID 2863395. doi:10.1016/s0022-5347(17)47438-6.
Spoljašnje veze[uredi | uredi izvor]
- Spermatogeneza — na sajtu Bionet škole
- Spermatogenesis — male reproductive physiology
- Spermatogenesis animation
Dodatna literatura[uredi | uredi izvor]
- Krunić Miloje, Ivo S. i Božidar Ć. (2010). Biologija za drugi ili prvi razred medicinske i drugi razred veterinarske škole. Zavod za udžbenike, Beograd. ISBN 978-86-17-166739
- Hale. W, G, Morgham, J, P: Školska enciklopedija biologije. Knjiga-komerc, Beograd
