Motorni protein
Motorn protein spada u klasu molekulskih motora koji su se sposobni da se kreću duž površine odgovarajućeg supstrata. Oni pretvaraju hemijsku energiju u mehanički rad, putem hidrolize adenozin trifosfata (ATP). Rotacija bičeva, međutim, počiva na snazi protonske pumpe.[1][2][3][4][5]

Šta su motorni proteini?[уреди | уреди извор]
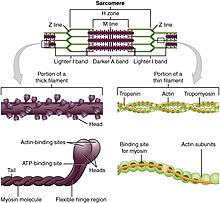
Motorni proteini, poput miozina i kinezina, su molekuli koji se kreću duž citoskeletnih filamenata preko mehanizma zavisnog o snazi kojom ih pokreće hidroliza ATP molekula. Hidroliza nukleotida i kontrolisano oslobađanje anorganskog fosfata kod motornih proteina uzrokuje restrukturiranje osnovnih domena koji kontrolišu povezanost motornog proteina sa vlaknima, drugih proteina i sveže snabdevanje nukleotida.[6][7]
Motorni proteini se kreću duž citoskeleta koristeći mehanohemijski ciklus vezivanja filamenata, promenu konformacije, otpuštanje niti, preokret konformacije i ponovno vezanje niti. U većini slučajeva, konformaciona promena na motornom proteinu sprečava naknadno vezanje nukleotida i/ili hidrolizu do narednog kruga hidrolize i oslobađanja.[6]
Kontrolisana hidroliza nukleotida i oslobađanje anorganskog fosfata u motornim proteinima mogu stvoriti mehaničke sile koje se mogu koristiti za:[6]
- Premeštanje samih motornih proteina duž niti
- Kontraktilna stresna vlakna i prenošenje tereta koji je pričvršćen na motorni protein (npr vezikule, organele, drugi proteini) u određene regije u ćeliji
- Transport supstanci u određenom smeru ili polaritetu duž niti. Ova usmerenost postiže se specifičnim konformacijskim promenama koje omogućavaju kretanje u samo jednom smeru.[8]
Ćelijske funkcije[уреди | уреди извор]
Motorni proteini poput kinezina su pokretačka snaga ključnih procesa u ćeliji. Na primer, kada se ćelije dele, kinezini mehanički izvlače hromozome; oni transportuju "pakete" s jednog dela ćelije u drugu uz male "kolovozne" trake - mikrotubule ćelije. Sa dužinom od oko 60 nanometara, ti mikroproteini su nevidljivi za oči, ali imaju ogromne učinke. Ako interni ćelijaki prenos unutar ćelije prestane raditi, npr. može doći do Alchajmerove bolesti. Zato je od osnovne važnosti u biologiji razumeti kako se "motori" kreću duž mikrotubula. Informacije o njihovoj funkciji mogu biti korisne u razvoju terapije neurodegenerativnih bolesti ili neželjenih dejatava ćelije u slučajevima raka.[6][9]
Najistaknutiji primer motornog proteina je mišićni protein miozin koji je „motor" kontrakcije mišićnih vlakana kod životinja. Motorni proteini su pokretačka sila i za veći deo aktivnog transporta proteina i vezikula u citoplazmi. Kinezini i citoplazmatski dineini imaju osnovne uloge u unutarćelijskom transportu, kao što je aksonski transport, formiranje debenog vretena i odvajanje u hromozom za vreme mitoze i mejoze. Aksonemski dinein, koji se nalazi u cilijama i bičevima, od presudne je važnosti za pokretljivost ćelije, npr. spermatozoida, kao i transport tečnosti ili sluzi, na primer, u trahejama.
Bolesti uzrokovane defektima u motornim proteinima[уреди | уреди извор]
Značaj motornih proteina u ćelijama ogleda se u ispunjavaju njihovih funkcij, pa tako npr. nedostaci kinezina su identificirani kao uzrok Charcot-Marie-Tooth bolesti i nekih bolesti bubrega, a nedostaci dineina mogu dovesti do hronične infekcije disajnih puteva ako treplje ne funkcionišu bez dineina.
Brojni nedostaci miozina odnose se na stanja bolesti i genetičkih kontrolisanih sindroma. Zbog nedostatka miozina II, neophodnog za kontrakciju mišića, oštećenja miozin u mišićima izaziva miopatije. Zbog toga što je miozin II potreban u procesu slušanja posebno u strukturi steretreplji, defekt u nekonvencionalnom miozinu može dovesti do Ašerovog sindroma i nesindromske gluvoće.[10]
Citoskeletni motorni proteini[уреди | уреди извор]
Motorni proteini koji se koriste u citoskeletu za kretanje, svrstavaju se u dve kategorije, a na osnovu njihovih supstrata:[11][12][13]
- aktinski motori poput miozina koji se kreću zajedno sa mikrofilamentima, preko interakcije s aktinom.
- Mikrotubulni motori, kao što su dinein i kinezin koji se premeštaju zajedno u mikrotubulu, putem interakcije s tubulinom. Postoje dvije osnovne vrste mikrotubulskih motora: plus-kraj motori i minus kraj motori, koji se ovako dele na osnovu smera u kome „hoda" uz mikrotubulske snopove unutar ćelije.[14]
Aktinski motori[уреди | уреди извор]
Miozin[уреди | уреди извор]
Natporodica miozinskih aktinskih motornih proteina koji pretvaraju hemijsku energiju ATP u mehaničku, koja generira snagu i kretanje. [15]Prvoidentificirani miozin, miozin II, je odgovoran za stvaranje mišićne kontrakcije.[16] Miozin II je izduženi protein koji je oblikovan od dva teška lanca s motorim glavama i dva lahka lanca. Svaka glava miozina sadrži aktin i vezani ATP. Miozinske glave vežu i hidroliziraju ATP, koji daje energiju kretanja prema plus kraju aktinske niti. Miozin II je također značajan u procesu ćelijske diobe.[17] Naprimjer, nemišićnia bipolarna, tanka vlakna miozina II daju snagu kontrakcije koja je potrebna da se, tokom citokineze, ćelija podijeli u dvije ćelije kćeri.[18] Osim miozina II, i mnogi drugi tipovi miozina su odgovorni za različite oblike kretanja nemišićnih ćelija. Naprimer, miozini I su uključeni u unutarćelijskui organizaciju i izbočine aktinom bogatih struktura na površini ćelije. Miozin V,[19] je uključen u vezikule i transportne organele.[20] Miozini XI učestvuju u citoplazmatskoj struji, u kome zajedničko kretanje struja u određenom smeru u mikrofilamenatnim mrežama u ćeliji omogućuju organele i citoplazma.[21][22][23][24][25]
- Gljive (Kvasac): 5
- Biljke (Arabidopsis thaliana): 17
- Insekti (Drosophila): 13
- Sisari (čovek): 40
- Nematode (Caenorhabditis elegans): 15
Mikrotubulski motori[уреди | уреди извор]
Kinezin[уреди | уреди извор]

Kinezini su porodica molekularnih motora koji koriste puteve mikrotubula i anterogradnog pokreta. Oni igraju važnu ulogu u anterogradnom transportu tereta (organele, proteinski kompleksi, vezikule) duž aksonskih mikrotubula na način zavisan od ATP-a. Takođe je poznato da su kinezini uključeni u organizaciju hromozomalnih i mitotičkih kretanja deobnog vretena. Kinezini se vežu za mikrotubule preko dinamike domena motora, a za teret preko dinamike repnih domena.[28]
Oni su od vitalnog značaja za formiranje debenog vretena i odvajanje hromozoma u mitozi i mejozi i odgovorni za naginjanje mitohondrija, Goldžijevog tela i vezikula u eukariotskim ćelijama.
Kinezini imaju po dva teška i laka lanca po aktivnom motoru. Dva loptasta domena motornih glava i teških lanaca mogu hidrolizom hemijsku energiju ATP pretvoriti u mehanički rad za kretanje uz mikrotubule. [29]
Pravac u kome se prevozi teret može biti prema plus ili minus-kraju, u zavisnosti od vrste kinezina.[30] U principu, kinezini sa N-terminalnim motornim domenom prenose teret prema plus krajevima mikrotubula koji se nalaze na periferiji ćelije, dok kinezini sa C-krajevima motornih domena tereta nose prema minus krajevima mikrotubula, koji se nalaze na jedru.
Poznato je 14 različitih varijanti porodice kinezina, uz neke dodatne kinezinolike forme, kao što su proteini koji se ne mogu svrstati u ovu porodicu.[31]
- Genomski predstavnici kinezinskih motora,[26]
- Gljive (kvasac): 6
- Biljke (Arabidopsis thaliana): 61
- Insekti (Drosophila melanogaster): 25
- Sisari (čovek): 45
Dinein[уреди | уреди извор]
Dineini su mikrotubulski motori sposobni za retrogradne klizne pokrete. Dineinski kompleksi su mnogo veći i kompleksniji nego kinezinski i miozinski motori.[32] Dienini se sastoje od dva ili tri teška lanca i velikog i varijabilnog broja povezanih lakih lanaca. Mogu obavljati unutarćelijski transport celularni minus krajem mikrotubula koji se nalazi u centru organizacije mikrotubule, u neposrednoj blizini jedra.[33] Porodica dineina ima dve velike grane:[34][35][36]
- Jedna je aksonemski dinein koji olakšava pokrete cilija i bičeva i brzih i efikasnih kliznih pokreta mikrotubula.[37]
- Drugi je citoplazmatski dinein, koji olakšava transport unutarćelijskih tereta.[38][39]
Od 15 vrsta aksonemskog dineina, poznata su samo dva citoplazmatska] oblika.[40]
- Genomski predstavnici dineinskih motora,[26]
- Gljive (kvasac): 1
- Biljke (Arabidopsis thaliana): 0
- Insekti (Drosophila melanogaster): 13
- Sisari (čovjek): 14-15
Specifični biljni motori[уреди | уреди извор]
Nasuprot životinjama, gljivama i nevaskularnim biljkama, ćelijama cvetnica nedostaju dineinski motori. Međutim, one imaju veći broj različitih kinezina. Mnogi od tih iz grupe biljno specifičnih kinezina, specializirani su za funkcije tokom mitoze.[41]
Biljne ćelije se razlikuju od životinjskih po tome što imaju ćelijski zid. Tokom mitoze, novi ćelijski zidovi nastaju formiranjem ćelijske ploče, počevši od središta ćelije. Taj proces olakšan je mitoznim fragmoplastom, nizom mikrotubula koji su jedinstveni za biljne ćelije. Izgradnja ćelijske ploče i na kraju novog ćelijskog zida zahteva kinezinu slične motorne proteine.[42]
Od ostalih motornih proteina koji su bitni za deobu biljnih ćelija, treba navesti kinezinoliki kalmodulin-vezujući protein (KCBP), koji je jedinstven za biljke i deo kinezina i deo miozina.[43]
Ostali molekulski motori[уреди | уреди извор]
Osim pomenutih motornih proteina, postoji mnogo više vrsta proteina koji mogu formirati snagu i moment sile u ćeliji. Mnogi od tih molekulskih motora su sveprisutniji i u prokariotskim i eukariotskim ćelijama, iako su neki, poput onih koji su uključeni u citoskeletne elemenate ili hromatin, jedinstveni za eukariote. Motorni protein prestin,[44] koji se javlja kod sisara u kohlearnim spoljašnjim ćelijama, daje mehaničko ojačanje pužu. To je jednosmerni napon za pretvaranje snage, koji deluje oko mikrosekunde i poseduje piazoelektrična svojstva.
Vidi još[уреди | уреди извор]
Izvori[уреди | уреди извор]
- ^ Campbell N. A.; et al. (2008). Biology. 8th Ed. Person International Edition, San Francisco. ISBN 978-0-321-53616-7.
- ^ Sofradžija A., Šoljan D., Hadžiselimović R. (2004). Biologija 1. Svjetlost, Sarajevo. ISBN 978-9958-10-686-6.
- ^ Međedović S., Maslić E., Hadžiselimović R. (2002). Biologija 2. Svjetlost, Sarajevo. ISBN 978-9958-10-222-6.
- ^ Alberts B.; et al. (2002). Molecular Biology of the Cell, 4th Ed. Garland Science. ISBN 978-0-8153-4072-0.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., ур. (2005). Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB) Sarajevo. ISBN 978-9958-9344-1-4.
- ^ а б в г Hwang W, and Lang MJ. Mechanical design of translocating motor proteins. Cell Biochem. Biophys. 2009; 54(1-3):11-22. [Hwang, W.; Lang, M. J. (2009). „Mechanical design of translocating motor proteins”. Cell Biochemistry and Biophysics. 54 (1–3): 11—22. PMC 3870332
 . PMID 19452133. doi:10.1007/s12013-009-9049-4.]
. PMID 19452133. doi:10.1007/s12013-009-9049-4.]
- ^ Cheng F, Eriksson JE. 2016. Intermediate filaments and the regulation of cell motility during regeneration and wound healing. Cold Spring Harb Perspect Biol Cheng, Fang; Eriksson, John E. (2017). „Intermediate Filaments and the Regulation of Cell Motility during Regeneration and Wound Healing”. Cold Spring Harbor Perspectives in Biology. 9 (9): a022046. PMC 5585849
 . PMID 28864602. doi:10.1101/cshperspect.a022046.
. PMID 28864602. doi:10.1101/cshperspect.a022046.
- ^ „What are Motor Proteins?”. National University of Singapore. Архивирано из оригинала 15. 12. 2019. г. Приступљено 15. 12. 2019.
- ^ Hoyt, M. Andrew; Hyman, Anthony A.; Bähler, Martin (1997). „Motor proteins of the eukaryotic cytoskeleton”. Proceedings of the National Academy of Sciences. 94 (24): 12747—12748. Bibcode:1997PNAS...9412747H. PMC 34170
 . PMID 9398068. doi:10.1073/pnas.94.24.12747
. PMID 9398068. doi:10.1073/pnas.94.24.12747  .
.
- ^ Hirokawa N, Tekamura R (2003). „Biochemical and molecular characterization of diseases linked to motor proteins”. Trends in Biochemical Sciences. 28 (10): 558—565. PMID 14559185. doi:10.1016/j.tibs.2003.08.006.
- ^ Howard, Jonathon (6. 12. 2005). Mechanics of motor proteins and the cytoskeleton. Sinauer. ISBN 9780878933334.
- ^ „Motor protein function - Latest research and news | Nature”. www.nature.com. Приступљено 2021-01-28.
- ^ Kull FJ, Endow SA. 2013. Force generation by kinesin and myosin cytoskeletal motor proteins. J Cell Sci 126: 9–19
- ^ „Stepping Mechanism of Molecular Motor Protein”. www.ks.uiuc.edu. Приступљено 2021-01-28.
- ^ McIntosh, B. B. & Ostap, E. M. Myosin-I molecular motors at a glance. J. Cell Sci. 129, 2689–2695 (2016).
- ^ De La Cruz EM, Ostap EM, Sweeney HL. 2001. Kinetic mechanism and regulation of myosin VI. J Biol Chem 276: 32373–32381
- ^ Pyrpassopoulos, S. et al. Force Generation by Membrane-Associated Myosin-I. Sci. Rep. 6, 25524 (2016).
- ^ Komaba, S. & Coluccio, L. M. Localization of Myosin 1b to actin protrusions requires phosphoinositide binding. J. Biol. Chem. 285, 27686–27693 (2010).
- ^ Coureux PD, Wells AL, Ménétrey J, Yengo CM, Morris CA, Sweeney HL, Houdusse A. 2003. A structural state of the myosin V motor without bound nucleotide. Nature 425: 419–423.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002-01-01). „Molecular Motors”. Garland Science.
- ^ Extension of a three-helix bundle domain of myosin VI and key role of calmodulins. Yanxin Liu, Jen Hsin, HyeongJun Kim, Paul R Selvin, and Klaus Schulten. Biophysical Journal, 100:2964-2973, 2011.
- ^ Hartman, M. Amanda; Spudich, James A. (2012-04-01). „The myosin superfamily at a glance”. Journal of Cell Science. 125 (Pt 7): 1627—1632. ISSN 1477-9137. PMC 3346823
 . PMID 22566666. doi:10.1242/jcs.094300.
. PMID 22566666. doi:10.1242/jcs.094300.
- ^ Thompson RF, Langford GM (2002). „Myosin superfamily evolutionary history”. The Anatomical Record. 268 (3): 276—289. PMID 12382324. S2CID 635349. doi:10.1002/ar.10160.
- ^ Formation of salt bridges mediates internal dimerization of myosin VI medial tail domain. HyeongJun Kim, Jen Hsin, Yanxin Liu, Paul R. Selvin, and Klaus Schulten. Structure, 18:1443-1449, 2010.
- ^ Almeida, C. G. et al. Myosin 1b promotes the formation of post-Golgi carriers by regulating actin assembly and membrane remodelling at the trans-Golgi network. Nat. Cell Biol. 13, 779–789 (2011).
- ^ а б в Vale, RD (2003). „The molecular motor toolbox for intracellular transport”. Cell. 112 (4): 467—480. PMID 12600311. S2CID 15100327. doi:10.1016/S0092-8674(03)00111-9.
- ^ Bresnick AR. 1999. Molecular mechanisms of nonmuscle myosin-II regulation. Curr Opin Cell Biol 11: 26–33.
- ^ Block SM, Goldstein LS, Schnapp BJ. 1990. Bead movement by single kinesin molecules studied with optical tweezers. Nature 348: 348–352
- ^ Verhey, Kristen J.; Kaul, Neha; Soppina, Virupakshi (2011-01-01). „Kinesin assembly and movement in cells”. Annual Review of Biophysics. 40: 267—288. ISSN 1936-1238. PMID 21332353. doi:10.1146/annurev-biophys-042910-155310.
- ^ Clancy BE, Behnke-Parks WM, Andreasson JO, Rosenfeld SS, Block SM. 2011. A universal pathway for kinesin stepping. Nat Struct Mol Biol 18: 1020–1027.
- ^ Miki H, Okada Y, Hirokawa N (2005). „Analysis of the kinesin superfamily: insights into structure and function”. Trends in Cell Biology. 15 (9): 467—476. PMID 16084724. doi:10.1016/j.tcb.2005.07.006.
- ^ Kon T, Oyama T, Shimo-Kon R, Imamula K, Shima T, Sutoh K, Kurisu G. 2012. The 2.8 Å crystal structure of the dynein motor domain. Nature 484: 345–350.
- ^ Roberts, Anthony J.; Kon, Takahide; Knight, Peter J.; Sutoh, Kazuo; Burgess, Stan A. (2013-11-01). „Functions and mechanics of dynein motor proteins”. Nature Reviews Molecular Cell Biology. 14 (11): 713—726. ISSN 1471-0072. PMC 3972880
 . PMID 24064538. doi:10.1038/nrm3667.
. PMID 24064538. doi:10.1038/nrm3667.
- ^ Ayloo S, Lazarus JE, Dodda A, Tokito M, Ostap EM, Holzbaur EL. 2014. Dynactin functions as both a dynamic tether and brake during dynein-driven motility. Nat Commun 5: 4807
- ^ Carter AP, Diamant AG, Urnavicius L. 2016. How dynein and dynactin transport cargos: A structural perspective. Curr Opin Struct Biol 37: 62–70
- ^ Gibbons IR, Rowe AJ. 1965. Dynein: A protein with adenosine triphosphatase activity from cilia. Science 149: 424–426
- ^ Davis L, Smith GR (2005). „Dynein promotes achiasmate segregation in Schizosaccharomyces pombe”. Genetics. 170 (2): 581—90.
- ^ Dixit R, Ross JL, Goldman YE, Holzbaur EL. 2008. Differential regulation of dynein and kinesin motor proteins by tau. Science 319: 1086–1089.
- ^ Hendricks AG, Lazarus JE, Perlson E, Gardner MK, Odde DJ, Goldman YE, Holzbaur EL. 2012. Dynein tethers and stabilizes dynamic microtubule plus ends. Curr Biol 22: 632–637.
- ^ Mallik R, Gross SP (2004). „Molecular motors: strategies to get along”. Current Biology. 14 (22): R971—R982. PMID 15556858. S2CID 14240073. doi:10.1016/j.cub.2004.10.046.
- ^ Vanstraelen M, Inze D, Geelen D (2006). „Mitosis-specific kinesins in Arabidopsis”. Trends in Plant Science. 11 (4): 167—175. PMID 16530461. doi:10.1016/j.tplants.2006.02.004. hdl:1854/LU-364298.
- ^ Smith, LG (2002). „Plant cytokinesis: motoring to the finish”. Current Biology. 12 (6): R202—R209. PMID 11909547. S2CID 8250021. doi:10.1016/S0960-9822(02)00751-0.
- ^ Abdel-Gany I, Day IS, Simmons PK, Reddy AS (2005). „Origin and evolution of kinesin-like calmodulin-binding protein”. Plant Physiology. 138 (3): 1711—1722. PMC 1176440
 . PMID 15951483. doi:10.1104/pp.105.060913.
. PMID 15951483. doi:10.1104/pp.105.060913.
- ^ Dallos P, Fakler B (2002). „Prestin, a new type of motor protein.”. Nat. Rev. Mol. Cell Biol. 3 (2): 104—11. PMID 11836512. S2CID 7333228. doi:10.1038/nrm730.
Spoljašnje veze[уреди | уреди извор]
- MBInfo - What are Motor Proteins? (језик: енглески)
- Ron Vale's seminar: "Cytoskeletal Motor Proteins" (језик: енглески)
- Biology of Motor Proteins (језик: енглески)
 | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |
